Procesos unitarios y su clasificación
Procesos unitarios
Se denomina proceso unitario a la etapa en la que se produce alguna reacción química, los procesos unitarios (conversiones químicas) forman la estructura básica de un proceso industrial químico.
Entre los procesos unitarios, a manera de ejemplo, podemos mencionar las reacciones que se presentan a continuación:
- OXIDACIÓN: Proceso por el cual una especie química pierde electrones simultáneamente a la ganancia de los mismos por otra sustancia.
- COMBUSTIÓN: Reacción química entre una sustancia oxidante (comburente) y otra reductora (combustible) con desprendimiento de calor y eventualmente de luz.
- FERMENTACIÓN: Conjunto de reacciones químicas por las que una sustancia orgánica se transforma en otra por medio de ciertos microorganismos y generalmente va acompañada de gases.
- SAPONIFICACIÓN: proceso químico por el cual los esteres se desdoblan en ácidos y alcohol por acción del agua son acciones reversibles, muy lentas y en general catolizadas por ácidos minerales o por alcalosis.
- SULFHIDRACIÓN: Proceso de adicionar un reactivo que contenga sulfuro de hidrogeno.
- CAUSTIFICACIÓN: Proceso unitario que implica al carbonato sódico con cal y la producción electrolítica de sosa cáustica con sal común produciendo hidróxido sódico.
- HIDROGENACIÓN: Reacción química entre el hidrogeno molecular y un compuesto orgánico en presencia de catalizadores.
- ELECTRÓLISIS: Descomposición de sustancias que se encuentran disueltas o fundidas al paso de la corriente eléctrica. El proceso tiene lugar en una cuba electrolítica, de manera de que sobre el electrodos positivo y negativo se depositan los iones negativos y positivos respectivamente.
- ALOGENACIÓN: Consiste en insertar un átomo de cualquier halógeno en una cadena de compuesto orgánico por desplazamiento de una doble ligadura.
- POLIMERIZACIÓN: Es el proceso en el cual se forman productos de alto peso molecular a partir de materias primas de bajo peso molecular.
- REDUCCIÓN: Proceso químico caracterizado por la aceptación de electrones por parte de una molécula, átomo-ion.
- SULFONACIÓN: Es la introducción de un grupo ácido sulfónico (–SO 3H) en un compuesto orgánico.
- NITRACIÓN: Introducción del radical nitro (-NO) en un compuesto orgánico, formado por nitrocompuestos.
- ALQUIOLACIÓN: Introducción de una cadena alifática en un compuesto cíclico por sustitución de hidrogeno por un radical alquino.
Lo más importante de un proceso unitario no es el equipo en sí (que es un reactor) si no el mecanismo de la reacción, la velocidad de la misma o el equilibrio que se puede alcanzar; esto se estudia en Química General e Inorgánica, Química Orgánica, Fisicoquímica y Reactores.
La mayoría de los procesos químicos consisten por en una combinación de varios procesos y operaciones unitarias.
Clasificación de las reacciones químicas
Las reacciones químicas se clasifican por la energía que requieren o liberan, o bien por el proceso a que se someten los reactivos. Si una reacción química libera energía, se llama reacción exotérmica. El ejemplo más común es la combustión, en la cual la energía se manifiesta en forma de calor y luz. Si, por el contrario, la reacción química requiere energía del medio para efectuarse, recibe el nombre de reacción endotérmica. La fotosíntesis es un proceso de esta clase, porque requiere de la luz solar para realizarse.
 |
| Ejemplo de reacción endotérmica |
 |
| Ejemplo de reacción exotérmica |
Básicamente podemos clasificar las reacciones químicas en:
- Reacción de síntesis o adición
- Reacción de análisis o descomposición
- Reacción de desplazamiento o simple sustitución
- Reacción de doble desplazamiento o doble sustitución
Reacción de síntesis o combinación
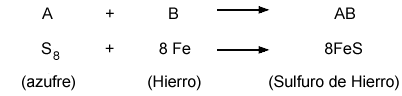
En ésta, dos o más sustancias se unen para formar otra; por ejemplo, cuando se combinan azufre y hierro, se sintetiza sulfuro de hierro. El polvo amarillo de azufre y la limadura de hierro reaccionan y se convierten en un nuevo producto que posee propiedades totalmente distintas de las que caracterizan a esos elementos.
Las reacciones de este tipo tienen gran utilidad industrial; gracias a ellas, cada día se cuenta con nuevos productos, como medicamentos, plástico, materiales cerámicos, etc.
Reacción de descomposición
En este caso, una sustancia se divide en otras dos, que forzosamente son más sencillas, es decir, están compuestas por menos átomos.
Muchas reacciones de descomposición requieren energía eléctrica para llevarse a cabo; por ejemplo, mediante la corriente eléctrica se pueden separar el oxígeno y el hidrógeno que forman el agua. El proceso que consiste en separar sustancias químicamente por medio de la electricidad se conoce como electrólisis.
Si en la reacción de análisis fuesen producidas apenas sustancias simples ella será total y si por lo menos uno de los productos fuese una sustancia compuesta ella será parcial.
Las reacciones de análisis pueden recibir nombres particulares, de acuerdo con el agente causante de la reacción.
- Pirólisis = descomposición por el calor
- Fotolísis = descomposición por la luz
- Electrólisis = descomposición por la electricidad
- Hidrólisis = descomposición por el agua
Reacciones de desplazamiento
Son las reacciones en que un elemento químico sustituye otro elemento de un compuesto, liberándolo como sustancia simple. Algunos ejemplos de estas reacciones son:
Las reacciones de desplazamiento ocurren cuando el elemento que sustituye otro, de la sustancia compuesta, es más reactivo.
El zinc es más reactivo que el hidrógeno. El orden de reactividad de los principales metales es observada en la tabla que sigue:
El cloro es más reactivo que el bromo. El orden de reactividad de los principales no metales es presentado en la tabla que sigue:
Reacciones de doble desplazamiento
Es cuando dos sustancias compuestas intercambian entre si partes de sus estructuras. Un ejemplo puede ser:
Las reacciones que presentan elementos químicos sufriendo oxidación o reducción son denominadas como reacciones de reducción-oxidación u oxi-reducción.
 |
| El fósforo sufre oxidación y el nitrógeno sufre reducción |
Algunas condiciones para que ocurra una reacción de doble desplazamiento son:
La información contenida en una reacción química
Una ecuación química es una forma sencilla de describir una reacción química: es como una oración gramatical, donde se usan fórmulas y símbolos en lugar de palabras. Por medio de una ecuación química se proporciona mucha información de manera concisa y breve.
El magnesio metálico y el oxígeno del aire dan lugar a una reacción de combustión, que produce óxido de magnesio. La ecuación que describe esta reacción es la siguiente:
En una ecuación química, el signo “+” se lee como “reacciona con” y la flecha, como “produce”. Los compuestos o elementos que aparecen del lado izquierdo de la flecha se denominan reactivos, y los de lado derecho, productos. En el ejemplo, los reactivos son el magnesio y el oxígeno; el producto, el óxido de magnesio.
El estado físico de las sustancias que intervienen en una reacción química también se indica en la ecuación; para ello se anotan subíndices entre paréntesis después de cada fórmula. Se usa el subíndice (s) cuando la sustancia aparece en estado sólido, (l) si es líquida y (g) cuando se presenta en forma de gas. Si alguno de los reactivos o productos está en disolución acuosa, se escribe (ac).
Las condiciones necesarias para efectuar una reacción pueden señalarse arriba o abajo de la flecha; éste seria el caso de alguna temperatura o presión determinadas. Una delta mayúscula (Ð), colocada sobre la flecha, indica que debe suministrarse calor para que se produzca la reacción. Ejemplo:
En el cuadro de abajo, están los símbolos de uso común en las reacciones químicas.
| Símbolo | Significado |
| $ \rightarrow $ | Produce (n) ; apunta hacia los productos |
| $ \leftrightarrows $ | Reacción reversible |
| $ \uparrow $ | Gas que se desprende; se escribe después de la fórmula |
| $ \downarrow $ | Sólido que se forma o precipitado; se anota después de la fórmula |
| $ (s) $ | Estado solido |
| $ (l) $ | Estado liquido |
| $ (g) $ | Estado gaseoso |
| $ (ac) $ | Disolución acuosa |
| $ \Delta $ | Calor |
| $ + $ | Más o reacciona con; se escribe entre las fórmulas de las sustancias |
Podemos también clasificar las reacciones en reversibles e irreversibles.
Reacciones reversibles
Son reacciones o procesos en que reactivos y productos son consumidos y producidos al mismo tiempo. Los reactivos y productos de estas reacciones son separados por una flecha doble.
La reacción que ocurre de la izquierda para la derecha se llama REACCIÓN DIRECTA; mientras que la que ocurre de la derecha para la izquierda se llama REACCION INVERSA.
Reacciones irreversibles
Son reacciones o procesos que ocurren en un único sentido.
Referencias
- Warren, McCabe & Smith Julian. (1998). Operaciones unitarias en ingeniería química.
- La Guía. (2010). Clasificación de las reacciones químicas. Obtenido de: https://quimica.laguia2000.com/reacciones-quimicas/clasificacion-de-las-reacciones-quimicas
- Raymond Chang. (2016). Quimica. 12ava Edición. McGraw-Hill.












Comentarios
Publicar un comentario