El proceso químico industrial y su clasificación de a cuerdo al modo de operación
Introducción
La mayoría de los procesos químicos consisten en una combinación de procesos unitarios y operaciones unitarias. Los procesos químicos en general y cada operación unitaria en particular tienen como objetivo el modificar las condiciones de una determinada cantidad de materia en una forma más útil para nuestros fines. Este cambio puede realizarse mediante tres formas:
- Modificando su masa o composición (separación de fases, mezcla, reacción química).
- Modificando el nivel o calidad de la energía que posee (enfriamiento, vaporización, aumento de presión, etc.).
- Modificando sus condiciones de movimiento (aumentando o disminuyendo su velocidad o su dirección).
Los tres cambios mencionados anteriormente son los únicos cambios posibles que un cuerpo puede experimentar. Un cuerpo está absolutamente definido cuando están especificadas:
- La cantidad de materia y su composición.
- La energía total (interna, eléctrica, magnética, potencial, cinética).
- Las componentes de velocidad por las cuales está animado.
Este hecho experimental tiene su expresión matemática en tres leyes de conservación:
El proceso químico industrial
La industria química se caracteriza por producir sustancias que normalmente no existen en la naturaleza, en la concentración y/o cantidad necesaria.
El método de obtención de los productos químicos se conoce como proceso químico, que consiste en un conjunto de transformaciones necesarias para obtener una sustancia, a partir de otra u otras, mediante mecanismos físicos y químicos. Un esquema fundamental de los procesos químicos se ilustra en la siguiente figura.
 |
| Diagrama de flujo fundamental del proceso químico. |
- La preparación de la materia prima puede integrarse de procesos térmicos, como calentamiento o enfriamiento, cambio de tamaño, separación de contaminantes, etcétera.
- La reacción puede realizarse de muy diversas formas, por ejemplo, puede ser o no catalizada, en estado gaseoso, o líquido o una mezcla de diferentes estados de agregación, etcétera.
- La purificación de los productos se debe normalmente a que los reactivos no se transforman completamente en el producto deseado y/o entran al reactor en cantidades no estequiométricas.
Una forma de clasificar los procesos consiste en dividirlos en dos grupos: las operaciones unitarias y los procesos unitarios. Las primeras se caracterizan porque no se presentan reacciones y en las segundas sucede lo contrario, se provoca una reacción.
Existe un conjunto de cualidades de los procesos que permiten asignarles nombres que los caracterizan, como procesos continuos o no continuos, procesos estacionarios, etcétera.
Clasificación de a cuerdo al modo de operación
Podemos distinguirlos como procesos continuos o discontinuos.
- Continuos (o flow): en este caso, en cada etapa las materias primas o los reactivos entran en forma continua al equipo y los productos salen de la misma forma.
- Discontinuos (o batch): en este caso, el equipo se carga con la alimentación, se realiza la operación o el proceso y luego se descarga el producto.
También se pueden distinguir dos tipos de estado al operar.
- El estado estacionario: cuando todos los parámetros que definen las corrientes que llegan o salen del equipo, como así también los que controlan el equipo (temperatura, presión, caudal, pH, etc.) no varían con el tiempo.
- El estado no estacionario o transitorio: cuando los parámetros mencionados anteriormente varían con el tiempo. Esta situación normalmente sucede cuando se pone en marcha (o se para) una planta o un equipo determinado.
Plantas de procesos químicos
Para fabricar productos es necesario diseñar, construir y operar una planta de procesos químicos. Regina (2007), define a las plantas de procesos químicos de la siguiente manera:
Las plantas de procesos químicos son instalaciones físicas en las cuales las materias primas sufren cambios físicos y químicos para generar los productos deseados.
Las plantas de procesos químicos abarcan todas las formas y tamaños, pero comparten muchos rasgos comunes. El flujo de materiales a través de una planta de procesos químicos se muestra visualmente sobre un diagrama de flujo de proceso. En general, una planta de procesos químicos contiene algunos, o todos, de los elementos siguientes
Usualmente las plantas de proceso químico presentan este conjunto de instalaciones
- Instalaciones para la preparación de la alimentación. Suministran las materias primas con la composición o estado físico adecuado.
- Reactores. Proporcionan las condiciones necesarias para permitir que las reacciones químicas deseadas tengan lugar bajo control.
- Separadores. Los productos deseados se separan de las materias primas, los subproductos y los residuos.
- Instalaciones de control ambiental. Manejan los residuos para garantizar una reutilización o eliminación seguras.
- Instalaciones de formulación de producto. Mezclan, formulan, empacan y almacenan el producto final.
- Equipo de transferencia de material. Mueve sólidos, líquidos y gases. (como bombas y red de tubería).
- Equipo de transferencia de energía. Proporciona refrigeración, calor y trabajo.
Ejemplo de proceso químico: El proceso de Haber-Bosch
El Proceso Haber combina nitrógeno del aire con hidrógeno derivado principalmente del gas natural (metano) en amoníaco. La reacción es reversible y la producción de amoníaco es exotérmica.
Un esquema de flujo para el Proceso Haber se ve así:
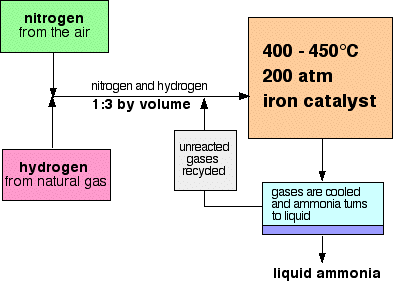
visto de otra manera con esquemas representativos de proceso:
La mezcla de nitrógeno e hidrógeno que ingresa al reactor tiene una relación de 1 volumen de nitrógeno a 3 volúmenes de hidrógeno.
La Ley de Avogadro dice que volúmenes iguales de gases a la misma temperatura y presión contienen cantidades iguales de moléculas. Eso significa que los gases van al reactor en la proporción de 1 molécula de nitrógeno a 3 de hidrógeno. Esa es la proporción demandada por la ecuación estequiometrica.
En algunas reacciones, puede optar por usar un exceso de uno de los reactivos. Haría esto si es particularmente importante utilizar la mayor cantidad posible del otro reactivo, si, por ejemplo, es mucho más costoso. Eso no se aplica en este caso.
Siempre hay una desventaja en el uso de cualquier otra cosa que no sean las proporciones de la ecuación. Si tiene un exceso de un reactivo, habrá moléculas que pasan a través del reactor que no pueden reaccionar porque no hay nada con lo que puedan reaccionar. Esto desperdicia espacio en el reactor, particularmente espacio en la superficie del catalizador.
Algunos factores de interés sobre el proceso son sus condiciones de operación, el catalizador es en realidad un poco más complicado que el hierro puro. Se le agrega hidróxido de potasio como promotor, una sustancia que aumenta su eficiencia. La presión varía de una planta de fabricación a otra, pero siempre es alta. No puedes equivocarte mucho en un examen que cita 200 atmósferas. En cada paso de los gases a través del reactor, solo aproximadamente el 15% del nitrógeno y el hidrógeno se convierten en amoníaco. (Esta cifra también varía de una planta a otra). Mediante el reciclaje continuo de nitrógeno e hidrógeno sin reaccionar, la conversión general es de aproximadamente el 98%.
Cuanto más baja es la temperatura que usa, más lenta se vuelve la reacción. Un fabricante está tratando de producir la mayor cantidad posible de amoníaco por día. No tiene sentido tratar de lograr una mezcla de equilibrio que contenga una proporción muy alta de amoníaco si la reacción tarda varios años en alcanzar ese equilibrio. Necesita que los gases alcancen el equilibrio en el muy poco tiempo en que estarán en contacto con el catalizador ubicado en el reactor.
Cuando los gases salen del reactor, están calientes y a una presión muy alta. El amoniaco se licua fácilmente bajo presión siempre que no esté demasiado caliente, por lo que la temperatura de la mezcla se reduce lo suficiente como para que el amoniaco se convierta en líquido. El nitrógeno y el hidrógeno permanecen como gases incluso bajo estas altas presiones, y pueden reciclarse.
Referencias
- Warren, McCabe & Smith Julian. (1998). Operaciones unitarias en ingeniería química.
- Regina M. Murphy. (2007). Introducción a los procesos químicos. McGraw-Hill.
- Jim Clark. (2013). THE HABER PROCESS. Recuperado de: https://www.chemguide.co.uk/physical/equilibria/haber.html



Comentarios
Publicar un comentario